مفاهيم الايزا از تئوری تا عمل
تهیه وتنظیم: علی سرخیل- کارشناس ارشد ایمونولوژی آزمایشگاه رفرانس- معاونت درمان دانشگاه علوم پزشکی ایران
مقـدمـه
اساسا” واکنشهای بین آنتیژن وآنتیبادی را میتوان هم درIn vivo و هم In vitro بررسی نمود و لذا مقوله بررسی واکنشهای بین آنتیژن وآنتیبادی، یکی از مهمترین شاخههای تحقیقاتی و کاربردی بشمار رفته، به طوریکه گاه نقطه عطفی در این میان پدید آمده و روش جدیدی مطرح گردیده که تا رسیدن به نقطه عطف دیگر و روشی تازه، تحقیقات در جهت اصلاح و بهبود روش قبلی ادامه یافته است. چرا که مسلما” هر روشی محاسن و معایب خاص خود را داشته که با توجه به آن گسترش یافته و یا محدود میشود؛ اما آنچه که مسلم است اینست که روشهای جدید همواره جایگزین روشهای قبلی نبوده، بلکه به موازات آنها از محدودیتهای موجود میکاهند.
طبقهبندی واکنشهای بین آنتیژن و آنتیبادی درIn vitro
اصولا” واکنشهای بین آنتیژن وآنتیبادی درIn vitro طی دو مرحله واکنشهای اولیه وثانویه اتفاق افتاده و بر این اساس دوروش کلی برای بررسی این واکنشها در In vitro وجود دارد:
الف- روشهای ایمونولوژیک که توانایی نشان دادن اتصال یک مولکول از آنتیژن را به یک مولکول آنتیبادی را در مراحل اولیه داشته و لذا مقادیر جزئی از آنتیژن و آنتیبادی را میتوانند شناسایی نمایند. بنابراین ازحساسیت، ویژگی و پتانسیل خاصی برخوردارند.
ب- روشهای سرولوژیک که برخلاف روشهای ایمونولوژیک، توانایی آنها در نمایش واکنشهای بین آنتیژن و آنتیبادی در مقادیر زیادی از آنتیژن و آنتیبادی بارز شده و لذا یا تقویت شده ی واکنش اولیه بین آنتیژن و آنتی بوده و یا اثرات ناشی از چنین واکنشهایی را نشان میدهند. این گروه از واکنشها را براساس شکل آنتیژن که ممکن است ذرهای، محلول و یا کلوئیدی باشد به ترتیب به انواع آگلوتیناسیون، پرسیپیتاسیون و فلوکولاسیون تقسیمبندی مینمایند.
تقسیمبندی واکنشهای ایمونولوژیک
با توجه به این که برای انجام واکنشهای ایمونولوژیک: 1- بایستی از یک ماده نشاندار که ممکن است رادیواکتیو، آنزیم یا فلوئورسانس بعنوان ردیاب یا نشانگراستفاده شود، 2- براساس این که آنالیت مورد سنجش یعنی آنتیژن یا آنتیبادی بایستی با این ماده نشاندار کونژوگه گردد و 3- واکنش بین آنتیژن یا آنتیبادی در فاز یا محیط جامد و یا مایع انجام میگیرد، واکنشهای ایمونولوژیک را براساس ترکیب ماده نشاندار، نوع آنالیت نشاندار شده و فاز واکنش تقسیمبندی مینمایند.
واکنشهای ایمونولوژیک را براساس نوع ماده نشاندار که ممکنست رادیواکتیو، آنزیم یا فلوئورسانس باشد، به انواع رادیوایمونواسی، آنزیم ایمونواسی و ایمونوفلوئورسانس تقسیم مینمایند. بدیهی است که در روش الایزا با توجه به اینکه از آنزیم برای نشاندارسازی استفاده شده است، لذا در واکنشهای آنزیو ایمونواسی قرار میگیرد.
براساس نوع فاز واکنش، واکنشهای ایمونولوژیک را به دو گروه تقسیم مینمایند:
الف- واکنشهای هموژن که در فاز مایع انجام گرفته و ماده نشاندار در واکنش بین آنتیژن و آنتیبادی دخالت دارد، لذا نیازی به جداسازی و شستشوی مولکولهای واکنشدهنده از مولکولهای آزاد نیست. این روش معمولا” برای شناسایی و اندازهگیری داروها و هاپتنها کاربرد داشته و لذا بطور معمول در آزمایشگاههای تشخیص طبی کاربردی ندارند.
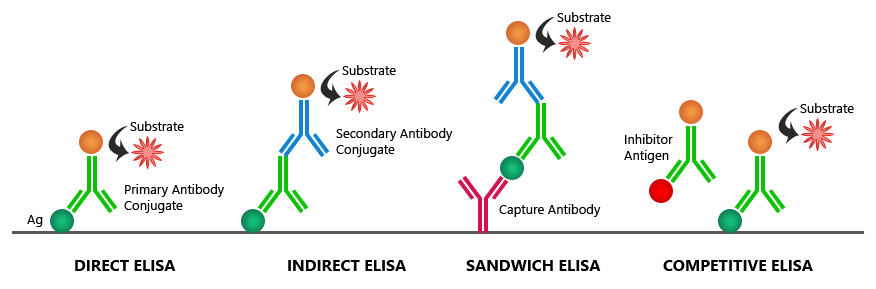
ب- واکنشهای هتروژن که بر خلاف روشهای هموژن در فاز جامد انجام گرفته، ماده نشاندار در واکنشهای بین آنتیژن و آنتیبادی دخالتی نداشته، بلکه فقط بعنوان ردیاب مورد استفاده قرار میگیرد. بنابراین جداسازی مولکولهای واکنشکننده از مولکولهایی که وارد واکنش نشدهاند، امری الزامی و ضروری میباشد. لازم بذکر است که این واکنشها در آزمایشگاههای تشخیص طبی کاربرد گستردهای داشته و روش الایزا در این گروه قرار میگیرد.
براساس نوع آنالیت نشاندار شده که ممکنست آنتیژن یا آنتیبادی با رادیواکتیو، آنزیم و یا فلوئورسانس نشاندار شده باشد، واکنشهای ایمونولوژیک را نیز به دو گروه تقسیم نموده و لذا از آنجایی که هدف ما بررسی واکنشهای الایزا میباشد، از اینرو انواع واکنشهای الایزا براساس نوع آنالیت نشاندار شده عبارتست از:
الف – آنزیم ایمونواسی یا EIA(Enzymo Immunometric Assay) که درآن آنتیژن نشاندار شده و آنتیبادی به کف چاهک پلیت الایزا چسبیده است. اساس واکنش EIA، رقابت بین آنتیژن نشاندار و آنتیژن آزاد موجود در نمونه مورد سنجش بر سر اتصال به آنتیبادی چسبیده به کف چاهک میباشد .
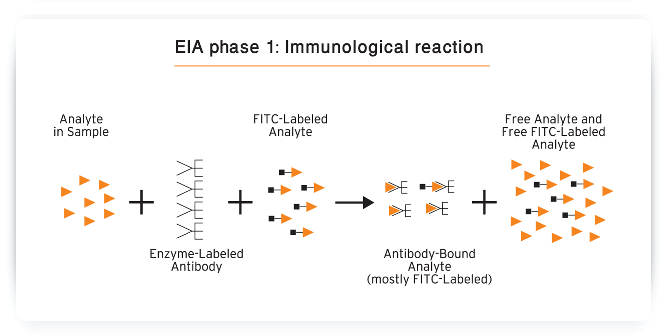
از آنجائیکه اساس روش EIA رقابت بوده و رقابت نیز در محدودیت معنا مییابد، به این روش معرف محدود(Restirected Reagent) نیز میگویند. ضمنا” از آنجائیکه هر چه میزان آنتیژن موجود در نمونه بیشتر باشد، آنتیژن نشاندار کمتری به آنتیبادی متصل میگردد، لذا میزان کمپلکس نشاندار با کمپلکس غیرنشاندار مورد سنجش، رابطه معکوس داشته و از اینرو منحنی استاندارد آن سیر نزولی دارد .
همچنین با توجه به افزودن همزمان آنتیژن آزاد و نشاندار، واکنش یک مرحلهای و مستقیم میباشد.
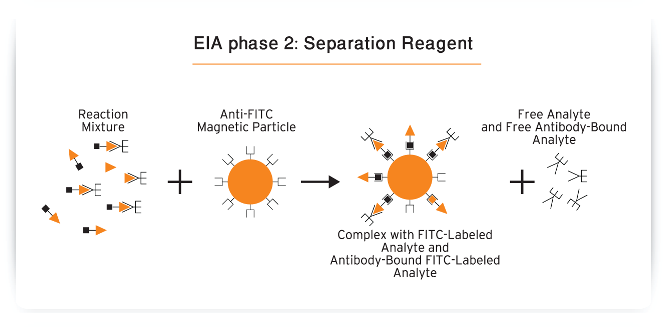
ب- ایمونوآنزیمومتریک اسی یا IEMA(Immuno Enzymo Meteric Assay) که درآن آنتیبادی بصورت نشاندار بوده و بسته به اینکه هدف سنجش آنتیژن یا آنتیبادی باشد، به روش ساندویچی انجام میگیرد، لذا در صورتیکه آنتیژن مورد سنجش باشد، روش را آنتیبادی ساندویچ یا Ag Capture و اگر آنتیبادی مورد سنجش باشد، روش را آنتیژن ساندویچ یا Ab Capture گویند.
در روش IEMA بدلیل اینکه رقابت وجود نداشته و برای اطمینان از کفایت آنتیبادیها برای تشکیل کمپلکس در غلظتهای بالای آنالیت همواره مقادیر زیادی از آنتیبادیها بکار میروند، لذا این روش را معرف مازاد (Excess Reagent ) نیز میگویند. در این روش با توجه به اینکه بازاء هر آنالیت یک کمپلکس نشاندار تشکیل میگردد، لذا رابطه مستقیم میان آنالیت وکمپلکس برقرار بوده و بنابراین منحنی استاندارد سیر صعودی دارد.
مزایای روشIEMA نسبت به EIA
نشاندارسازی آنتیبادی بجای آنتیژن در روش IEMA مزایای متدولوژیک زیادی را به ارمغان میآورد، که برخی از مهمترین آنها عبارتست از:
1- سهولت نشاندارسازی- با توجه به اینکه درروش EIA مولکولهای آنتیژن اغلب از جنس هاپتن بوده که مولکولهایی با جرم مولکولی کمتر از هزار دالتون میباشند، لذا محدودیت گروههای عاملی در مولکولهای مورد نظر، نشاندارسازی را محدود ساخته و اغلب نیاز به واکنشهای تخصصی و پیچیده دارد، اما در روش IEMA چون نشاندارسازی بر روی مولکول بزرگ آنتیبادی صورت میگیرد که دارای انواع گروههای عملکردی است؛ لذا نشاندارسازی آن براحتی با روشهای ساده و عمومی امکانپذیر است.
2- افزایش ویژگی- در روش EIA با توجه به اینکه از یک آنتیبادی برای شناسایی منفرد استفاده شده، درحالیکه در روش IEMA استفاده از دو آنتیبادی امکان شناسایی مضاعف را میسر میسازد، از اینرو ویژگی IEMA نسبت به EIA بیشتر است.
3- افزایش حساسیت- باتوجه به اینکه در روش IEMA بازاء تک تک آنالیتها، کمپلکس نشاندار وجود داشته و همچنین جایگاههای نشاندارسازی بالقوه آن بیشتر است، لذا هم بدلیل رابطه یک به یک بین آنالیت و کمپلکس نشاندار و هم بیشتر بودن جایگاههای بالقوه نشاندارسازی، حساسیت روش IEMA نسبت به EIA بیشتر است.
4- کاهش زمان انکوباسیون- با نظر به اینکه واکنش آنتیژن و آنتیبادی یک واکنش تعادلی دو طرفه بوده که طبق اصل لوشاتلیه با افزودن هر یک از مواد در یکی از طرفین معادله، تعادل بسمت طرف دیگر پیشرفت مینماید، از اینرو بدلیل اینکه در روش IEMA غالبا” رقابت وجود نداشته و برای حصول اطمینان ازکفایت آنتیبادیها بمنظور تشکیل کمپلکس در غلظت بالای آنالیت، همواره مقادیر زیادی از آنتیبادی بکار میرود؛ در نتیجه غلظت بالای مواد اولیه، سرعت به تعادل رسیدن یا زمان انکوباسیون را کاهش میدهد.
5- افزایش محدوده عملکرد (Work of range)– محدوده عملکرد که محدوده قابل اندازهگیری برای آنالیت بوده و فاصله بین اولین و آخرین نقطه استاندارد را شامل میشود، در روش IEMA حدود صد برابر بیشتر از EIA است.
6- کاهش اثر هوک (Hook Effect)– اثر هوک که عبارتست از کسب نتایج منفی کاذب در غلظت بالای آنالیت میباشد، در واکنشهای ایمونولوژی اتفاق افتاده و معادل پدیده پروزون در واکنشهای سرولوژی است. در این پدیده غلظت آنالیت که میتواند آنتیژن یا آنتیبادی باشد، از بالاترین استاندارد نیز بسیار بالاتر بوده و لذا علیرغم زیاد بودن آنتیژن یا آنتیبادی مورد آزمایش در سرم، نتیجه منفی کاذب حاصل میگردد.
بدلیل نتایج منحرفکننده و نامطلوبی که اثر هوک میتواند بر آزمونهای ایمنیسنجی باقی گذارد، تحقیقات زیادی در زمینه شناخت این پدیده و چگونگی خنثیسازی آن انجام شده است که یکی از آنها با توجه به اینکه پدیده هوک درروش EIAبدلیل تک مرحلهای و مستقیم بودن روش آزمایش، شایعتر از روش IEMA میباشد، عدم استفاده از این چنین کیتهایی میباشد. در شرایطی که ناچار به استفاده از چنین کیتهایی باشیم، برای اطمینان از صحت نتیجه، اولا” از کیتهایی استفاده شود که محدوده شروع پدیده هوک در آن قید شده باشد و ثانیا” بایستی هر جواب منفی را با رقتهای بالاتری از همان سرم تکرار نمود.
البته باید توجه داشت که اگرچه پدیده هوک غالبا در اثر فزونی آنالیت اتفاق میافتد، ولی تحقیقات انجام شده توسط محققان ثابت نموده که منحصرا” بالا بودن میزان آنالیت تنها عاملی نیست که در بروز این پدیده دخالت داشته و لذا عوامل دیگری نیز نظیر توزیع و پراکندگی اپیتوپها، وجود اپیتوپهای مشابه و یا استفاده از دو آنتیبادی مونوکلونال که بر ضد دواپیتوپ مختلف تهیه شدهاند، میتواند در بروز پدیده هوک موثر باشد؛ که نمونه آن نیز ایجاد پدیده هوک در روشهای IEMA علیرغم دو مرحلهای بودن آنها میباشد؛ که علت آن در نتیجه استفاده از دو آنتیبادی مونوکلونال بر ضد دواپیتوپ مختلف میباشد.
تعریف نهایی روش الایزا
با توجه به کلیات فوقالذکر در مورد انواع واکنشهای ایمونولوژی، روش الایزا را میتوان بطور خلاصه بصورت ذیل توصیف نمود:
الایزا، روش In vitro بررسی واکنش آنتیژن و آنتیبادی بطریق ایمنیسنجی درفاز جامد بوده که از آنزیم برای نشاندارسازی و ردیابی آنالیت مورد نظر استفاده شده است.
وسایل و تجهیزات مورد نیاز در روش الایزا
وسایل و تجهیزاتی که جهت انجام آزمایشات به روش الایزا انجام میگیرد، عبارتست از:
الف- کیت الایزا که خود متشکل از موارد ذیل است:
1- یک یا دوعدد پلیت 96 خانهای که در 12ستون هشت خانهای قرارگرفتهاند. هر یک ازخانهها را چاهک ( (Well و هر ستون هشت خانهای را یک استریپ (Strip) گویند. جنس چاهکها از پلیاستیرن، پلیوینیل کلراید و یا پلیپروپیلن بوده، عمقی حدود cm1 داشته و به اشکال ته صاف و یا ته گود میباشند، که بطورایده آل چاهکهای ته صاف برای قرائت اسپکتروفتومتری در سنجشهایی که در آنها پیشرفت رنگ وجود دارد، پیشنهاد میشود. لذا چاهکهای ته گود برای قرائت اسپکتروفتومتری مناسب نمیباشند.
2- ویالهای استاندارد، کنترل منفی و مثبت، که با توجه به نوع کیت میتوانند بصورت محلول یا لیوفیلیزه باشند.
3- رقیقکننده نمونه (Sample Diluents) که مزیت آن اینست که باتوجه به رقیق سازی نمونه، اثر هوک را تا حدود زیادی خنثی مینماید.
4- کونژوگه نشاندار شده با آنزیم که از مهمترین آنزیمهای مورد استفاده در الایزا میتوان از پراکسیداز ترب کوهی یا HRP، آلکالن فسفاتازوپنی سیلیناز نام برد که عمدتا” از پراکسیداز استفاده شده و از آلکالن فسفاتاز بعلت گرانی، در کارهای تحقیقاتی استفاده میشود. بایستی متذکر شد که آنزیم مورد استفاده برای نشاندارسازی، نقش مهمی در تعیین نوع سوبسترا و نیز نوع محلول متوقفکننده دارد.
5- محلول شستشو که متشکل از بافر فسفات سالین (PBS)، تواین 20 و تایمرسال میباشد. باید توجه داشت که هر چند PBS با تنظیم قدرت یونی وPH مناسب، اتصال غیراختصاصی به جدارچاهک را به حداقل میرساند؛ بااینحال برای افزایش دقت و نیز کاهش اتصالات غیراختصاصی، از مقدار کمی پروتئین ودترژان یعنی تواین 20 استفاده میشود. همچنین از آنجائیکه محیطهای بافری غالبا برای رشد میکروارگانیسمها بسیار مناسب میباشند، لذا از ترکیبات نگهدارنده نظیر تایمرسال و سدیم آزید استفاده میشود؛ که البته با توجه به اینکه سدیم آزید مهارکننده آنزیم پراکسیداز میباشد، از اینرو از تایمرسال استفاده میگردد.
6- محلول سوبسترا- کروموژن که میتواند هم بصورت منفک از یکدیگر و یا بصورت ترکیبی باشد.
لازم بذکر است که در واکنشهای آنزیمی، سوبسترا بر اساس حلالیت، میتواند محلول یا غیرمحلول باشد؛ که در سنجش الایزا بایستی سوبسترا محلول باشد، زیرا اگر غیرمحلول باشد، نمی توان محصول را با دستگاه خوانشگر الایزا یا الایزاریدر قرائت نمود و توضیح اینکه، سوبسترای غیرمحلول در روش دات الایزا (Dot ELISA) و بلاتینگ کاربرد دارد.
در مورد نوع سوبسترا نیز بایستی در نظر داشت، نوع سوبسترا بستگی به کونژوگه آنزیمی داشته و لذا اگر کونژوگه آنزیمی HRP باشد، سوبسترا میتواند تترامتیل بنزیدین (TMB) و یا ارتوفنل دی آمین (OPD) بوده و رنگ حاصل از واکنش آنزیمی آبی خواهد شد، اما اگر کونژوگه آنزیمی ALP باشد، سوبسترا پارانیتروفنل (PNP) بوده و رنگ حاصل از واکنش نیز، زرد خواهد شد.
7- محلول متوقفکننده یا بلوکر (Stopping or Blocking Solution) که باتوجه به نوع کونژوگه آنزیمی، میتواند اسیدی یا قلیایی باشد. بدین ترتیب که اگر کونژوگه آنزیمی HRP باشد، برای توقف واکنش بایستی ازمحلولهای اسیدی نظیر اسید کلریدریک و یا اسید سولفوریک استفاده نمود. ولی اگرکونژوگه ALP باشد، بایستی از محلولهای قلیایی نظیر NaOH استفاده کرد. لازم بذکر است که در اثر توقف واکنش توسط متوقفکننده اسیدی، رنگ آبی تبدیل به زرد شده، در حالیکه تغییر رنگ حاصل از کاربرد متوقفکننده قلیایی، بصورت تبدیل رنگ زرد به قهوهای خواهد بود.
ب- دستگاه خوانشگرالایزا یا الایزاریدر (ELISA Reader)– دستگاه الایزا ریدر که در نهاییترین مرحله آزمایش الایزا مورد استفاده قرار گرفته و جزء لاینفک تکنیک الایزا میباشد، در واقع شبیه اسپکتروفتومتر بوده، با این تفاوت که نوع کووت، مسیر خوانش و تعداد فیلترها تغییر نموده است. بدین ترتیب که بجای کووت، از چاهک استفاده شده و مسیر خوانش آن نیز برخلاف تکنیکهای فتومتری، بصورت عمودی میباشد. همچنین با توجه به اینکه در تکنیک الایزا از آنزیمها و سوبستراهای مشخصی استفاده میشود، از فیلترهای محدودی استفاده شده است.
دستگاههای الایزا ریدر براساس نوع و سیستم خوانشگر به سه دسته تقسیم میگردند، که عبارتست از:
1- Single Reader که تنها یک چاهک را بطریق دستی قرائت نموده و هیچگونه مد محاسباتی ندارند؛ لذا بایستی منحنی استاندارد تستهای کمی توسط آزمایشگر بطریق دستی رسم گردد. به همین علت از قیمت و کیفیت پائینی برخوردار بوده و خوشبختانه چنین دستگاههایی دیگر مورد استفاده قرار نگرفته و از صحنه بازار محو شدهاند.
2- Strip Reader که تعداد 3-1 استریپ 8 یا 12 تایی را بصورت اتومات قرائت نموده و در عین حال منحنی تستهای کمی را براساس مد محاسباتی رسم مینمایند. علاوه بر این، بعلت دارا بودن فیلترهای افتراقی (Differential Filters) قابلیت خوانش در دو طول موج (Bichromatic Reading) را که به دلایل متعددی مورد نیاز میباشد، بطور همزمان دارند که این دلایل عبارتست از:
الف- حذف رنگ زمینه آبی که در اثر واکنش آنزیم HRP باTMB بعد از نوآرایی رنگ آبی به زرد قرائت در طول موج رفرانس مورد نیاز میباشد.
ب- باتوجه به اینکه رنگ زرد دارای طیف بلند گذر میباشد که طول موجهای بالاتر از nm500 را بخوبی عبور داده و جذب آن در طول موجهای حدود nm 600 صفر است، لذا نمونه بایستی در طول موج رفرانس نیز قرائت شود و بدین جهت استفاده از طول موج رفرانس، نیاز به استفاده از بلانک را نیز منتفی میسازد. زیرا در روش (Bichromatic Reading) نمونه در طول موجهای گوناگون خوانده شده و سپس تفاضل جذبهای حاصله، مبنای تعیین غلظت قرار میگیرد.
3– Plate Reader که قابلیت خوانش یک پلیت 96 تایی را درحداقل زمان دارا بوده و لذا از سرعت، دقت و صحت بیشتری نسبت به دستگاههای Strip Reader برخودارند. از اینرو قیمت بالاتری را نیز دارند.
